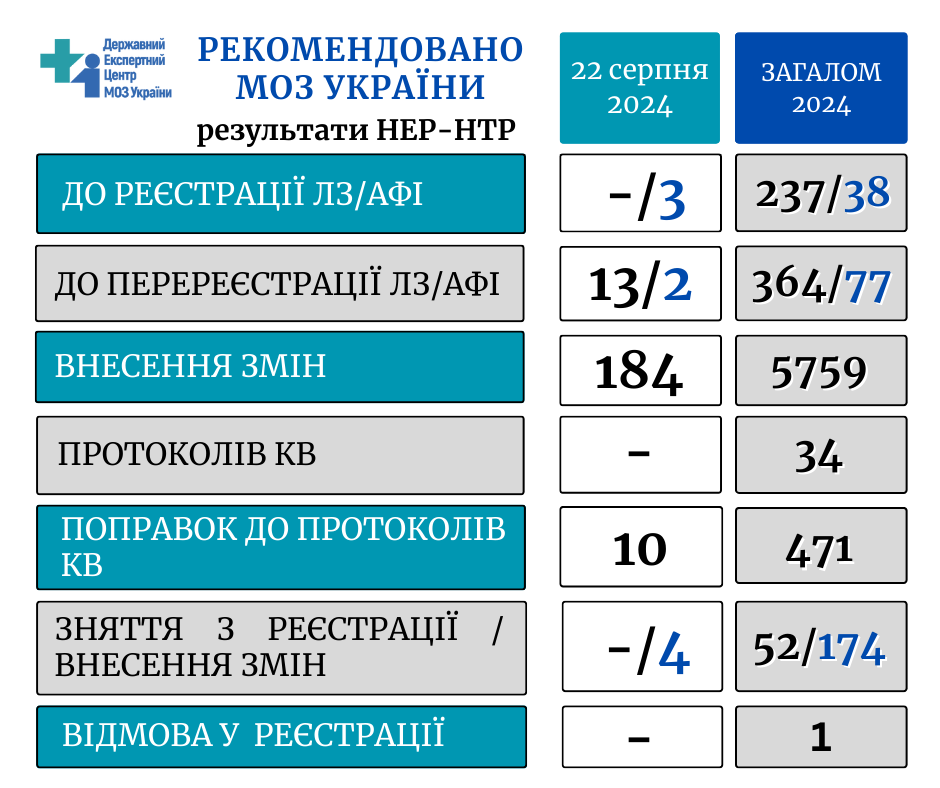
Цього тижня Центр надав до МОЗ України більше 220 рекомендацій у сфері державної реєстрації лікарських засобів в Україні.
За результатами експертного розгляду реєстраційних матеріалів на лікарські засоби та клінічні випробування, рішенням засідання науково-технічної ради Центру від 22.08.2024 р. Міністерству охорони здоров’я України рекомендовано:
до перереєстрації – 13 ЛЗ (із них 12 – на необмежений термін)
до реєстрації субстанцій – 3
до перереєстрації субстанцій – 2
внесення змін у реєстраційні матеріали на ЛЗ (щодо якості, безпеки/ефективності та фармаконагляду, адміністративні та інші зміни) – 184
до зняття з розгляду на різних етапах експертизи (за бажанням заявника) – 4 ЛЗ
поправок до протоколів міжнародних багатоцентрових клінічних випробувань ЛЗ – 10.