СТРУКТУРА СИСТЕМИ ФАРМАКОНАГЛЯДУ В УКРАЇНІ І КОНЦЕПТУАЛЬНЕ ВІДОБРАЖЕННЯ ПРОЦЕСУ ЗДІЙСНЕННЯ ФАРМАКОНАГЛЯДУ
Здійснення фармаконагляду має циклічний та безперервний характер. Усе починається з виявлення випадку ПР ЛЗ, що найчастіше може статися у закладі охорони здоров’я (далі – ЗОЗ), включаючи аптечний заклад, або на дому, де відбувається лікування хворого. Після цього працівник з медичною або фармацевтичною освітою, пацієнт або його представник чи заявник повинен повідомити про цей випадок у відповідні терміни та у форматі, що встановлені законодавством країни. Інформація про випадки ПР ЛЗ надсилається у єдиному напрямку до установи, яка координує здійснення фармаконагляду в країні. Саме там відбувається накопичення такої інформації та її аналіз, включаючи виявлення ризиків, оцінку ризиків та перваг щодо застосування ЛЗ. Результати аналізу стають підґрунтям для прийняття відповідних регуляторних рішень, які повинні бути оприлюднені та доступні як медичній громадськості, так і пересічним громадянам (рис. 1).
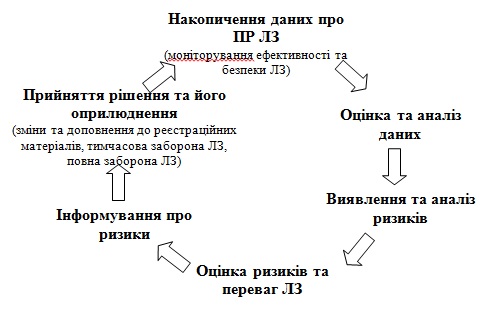
Рис. 1. Цикл здійснення фармаконагляду
Здійснення фармаконагляду є законодавчо врегульованим, як і весь процес обігу ЛЗ.
В Україні фармаконагляд врегульовано Законом України «Про лікарські засоби» 1996 р., зі змінами і доповненнями 1998 р., та низкою наказів МОЗ України:
- наказ МОЗ України від 27.12.2006 № 898 «Про затвердження Порядку здійснення фармаконагляду за побічними реакціями лікарських засобів, дозволених для медичного застосування» зі змінами і доповненнями, внесеними наказом МОЗ України від 29.12.2011 № 1005 (далі – наказ №898);
- наказ МОЗ України від 24.07.2009 № 531 «Про затвердження Порядку здійснення моніторингу безпеки і ефективностілікарських засобів в стаціонарах закладів охорони здоров’я»;
- наказ МОЗ України від 01.09.2009 № 654 «Про затвердження Плану заходів покращання здійснення післяреєстраційного нагляду за безпекою і ефективністю лікарських засобів і моніторингу безпеки і ефективності лікарських засобів у стаціонарах закладів охорони здоров’я»;
- наказ МОЗ України від 31.08.2010 № 736 «Про заходи щодо впровадження моніторингу безпеки та ефективності лікарських засобів у стаціонарах закладів охорони здоров’я».
Базовим нормативно-правовим документом, що регулює здійснення фармаконагляду, є наказ № 898, яким затверджено «Порядок здійснення нагляду за побічними реакціями лікарських засобів, дозволених до медичного застосування» (далі – Порядок).
Порядок гармонізований з положеннями Директиви Європейського Парламенту та Ради ЄС від 06.11.2001 р. №2001/83 ЄС, а також Постанови Ради ЄС від 22.07.1993 р. №2309/93 щодо здійснення фармаконагляду.
Порядком визначено загальні принципи здійснення нагляду за безпекою ліків, встановлено наступні джерела інформації про ПР ЛЗ:
– працівники з медичною та/або фармацевтичною освітою (лікарі, медичні сестри, акушери, фельдшери, провізори, фармацевти) усіх ЗОЗ незалежно від форм власності (форма 137/0, додаток 1 до Порядку);
-усі ЗОЗ незалежно від форм власності (форма 69-здоров, додаток 2 до Порядку);
-Державна служба України з лікарських засобів (далі – Держлікслужба);
-виробники/заявники (або їх представники) (форма повідомлення про ПР/відсутность ефективності (ВЕ) ЛЗ, дозволеного до медичного застосування, додаток 1 до Порядку; регулярно оновлюваний звіт з безпеки ЛЗ, дозволеного до медичного застосування, додаток 4 до Порядку);
-пацієнти та/або їх представники, організації, які представляють інтереси пацієнтів (додаток 3 до Порядку);
-регіональні відділення з фармаконагляду Центру;
міжнародні організації: Дитячий фонд Організації об’єднаних націй (UnitedNationsInternationalChildren’sFund (ЮНІСЕФ), Всесвітня організація охорони здоров’я (ВООЗ), міжнародні агентства Європейська агенція з оцінки лікарських препаратів (The European Agency for Evaluation of Medicinal Products (ЕМА), Американське управління з контролю за продуктами та лікарськими засобами (Food and Drug Administration (FDA), Регуляторне агентство Великобританії з контролю за лікарськими засобами та медичною продукцією (The Medicines and Healthcare Products Regulatory Agency (MHRA), Міністерство охорони здоров’я Канади (Health Canada), Австралійське агентство з контролю за лікарськми засобами (TherapeuticGoodsAdministration (TGA), Швейцарське агентство з контролю за лікарськими засобами (SwissAgencyForTherapeuticProducts (Swissmedic), Японське агентство з контролю за лікарськими засобами та виробами медичного призначення (PharmaceuticalsMedicalDevicesAgency (PMDA) та інші;
-медичні інформаційні джерела та наукові видання.
Відповідно до Положення про Міністерство охорони здоров’я України (далі – Положення), затвердженого Указом Президента України від 13.04.2011р. №467/2011, МОЗ України є головним органом у системі центральних органів виконавчої влади у формуванні та забезпеченні реалізації державної політики у сфері охорони здоров’я, зокрема, у сфері контролю якості та реалізації лікарських засобів, медичних імунобіологічних препаратів і медичних виробів, протидії ВІЛ-інфекції/СНІДу та іншим соціально небезпечним захворюванням (абзац 2 пункту 1 Положення). Також МОЗ України, відповідно до покладених на нього завдань у сфері створення, виробництва, контролю якості та реалізації лікарських засобів, медичних імунобіологічних препаратів і медичних виробів, затверджує порядки здійснення нагляду за ПР ЛЗ, дозволених до медичного застосування (абзац 11 підпункту 8.8 Положення). Порядок здійснення нагляду за ПР ЛЗ, дозволених до медичного застосування, затверджено наказом №898, а здійснення нагляду за ПР ЛЗ, дозволених до медичного застосування, покладено МОЗ України на Державне підприємство «Державний експертний центр МОЗ України» (пункт 1.3 розділу 1 Порядку, затвердженого наказом №898) (далі – Центр).
Система фармаконагляду в Україні існує з 1996 р.
Державна система фармаконагляду представлена центральною ланкою – Департаментом післяреєстраційного нагляду (далі – Департамент), що є структурною одиницею Центру. Регіональною мережею регіональних відділень (n=25), які діють в усіх областях України та місті Києві. На локальному рівні система фармаконагляду представлена відповідальними за здійснення фармаконагляду у закладах охорони здоров’я (ЗОЗ), переважно – заступники головних лікарів, або завідувачі відділень. Законодавством України передбачено взаємозв’язок між усіма структурами, дотичними до процесу обігу ЛЗ з питань їх безпеки. Функціонально-організаційна модель системи фармаконагялду України представлена на рисунку 2.
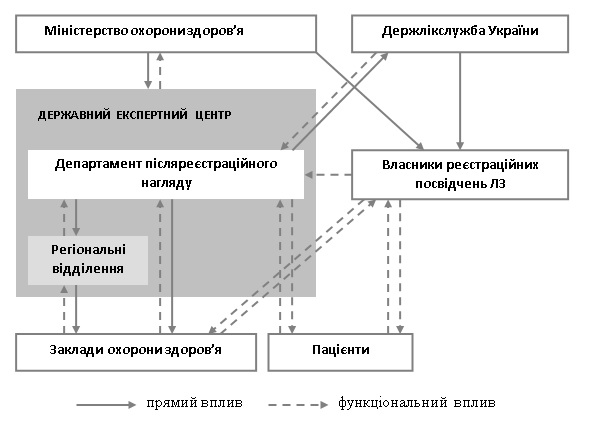
Рис. 2. Функціонально-організаційна модель системи фармаконагляду України
Порядком встановлено алгоритм надання карт-повідомлень про ПР та/або ВЕ ЛЗ лікарями, що представлений на рисунку 3.
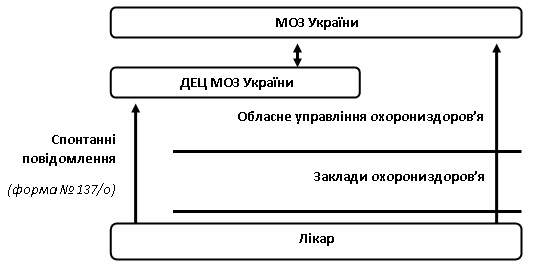
Рис. 3. Алгоритм надходження інформації про ПРта/або ВЕ ЛЗ в Україні від лікарів
У 2002 р. Україна стала дійсним членом міжнародної Програми ВООЗ моніторингу лікарських засобів (WHO Programme for International Drug Monitoring) і регулярно надає відомості про випадки ПР ЛЗ, що виникли при їх медичному застосуванні на території України. Інформація базується на даних спонтанних повідомлень, одержаних від лікарів. Дані, надані у відповідному форматі до Центру ВООЗ (м. Уппсала, Швеція), заносяться в міжнародну базу даних. Це дає можливість співпрацювати та за необхідності обмінюватись інформацією з безпеки ліків з іншими державами-учасниками програми ВООЗ з моніторингу за ПР ліків по системі VigiMed. Повідомлення про ПР мідекаміцину (2003 р.) та вінпоцетину (2010 р.), що надійшли з України, стали підґрунтям генерації сигналу* ВООЗ на ці ЛЗ.
Станом на 01.01.2013 р. база даних України про ПР ЛЗ становить понад 52825 повідомлень, що надійшли від лікарів (рис. 4).
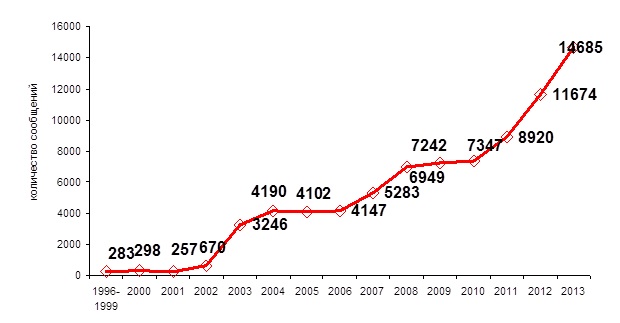
Рис. 4. Динаміка надходження повідомлень про побічні реакції лікарських засобів від лікарів України
Кожного року кількість повідомлень про ПР ЛЗ зростає внаслідок розширення кола інформаторів про випадки ПР ЛЗ (рис. 2). Останнє є результатом безперервної роботи співробітників Департаменту післяреєстраційного нагляду (далі − Департамент) та його регіональних відділень з медичною громадськістю. Завдяки цьому формується погляд лікарів до проблеми безпеки ЛЗ та відбувається їх залучення до здійснення фармаконагляду.
На думку експертів ВООЗ, система фармаконагляду вважається дієвою, коли протягом року на 1 млн. населення надходить не менше 100 повідомлень про випадки ПР ЛЗ. Оптимальним є надходження 500 повідомлень про ПР ЛЗ на 1 млн. населення. Прикладом може бути Швейцарія, у якій протягом року надходить не менше 500 повідомлень про ПР ЛЗ. В Україні у 2012 р. рівень надходження повідомлень про ПР ЛЗ досяг 254 на 1 млн. населення, що свідчить про достатній рівень інформування, який має потенціал до зростання.
* Сигнал – це інформація з одного або декількох джерел (включаючи спостереження та експерименти), яка передбачає наявність нового причинно-наслідкового зв’язку або нового аспекту відомого зв’язку між втручанням і подією або низкою взаємопов’язаних подій, як негативних, так і позитивних, і яка є досить достовірною щоб бути підставою для проведення заходів з перевірки.
(Звіт VIII робочої групи Ради міжнародних науково-медичних організацій «Практичні аспекти виявлення сигналу в фармаконагляду» (CIOMS, Geneva 2010))