До уваги заявників!
Проведення аудиту систем фармаконагляду заявників здійснює Державний експертний центр МОЗ відповідно до положень глави 2 розділу VII Порядку здійснення фармаконагляду, затвердженого наказом Міністерства охорони здоров’я України від 27 грудня 2006 року № 898 (у редакції наказу Міністерства охорони здоров’я України від 26 вересня 2016 року № 996) (далі – Порядок здійснення фармаконагляду). Та оприлюднює їх результати відповідно до вимог Порядку здійснення фармаконагляду.
В структурі Державного експертного центру МОЗ Центру функції проведення аудиту систем фармаконагляду покладено на Відділ аудиту систем фармаконагляду заявників.
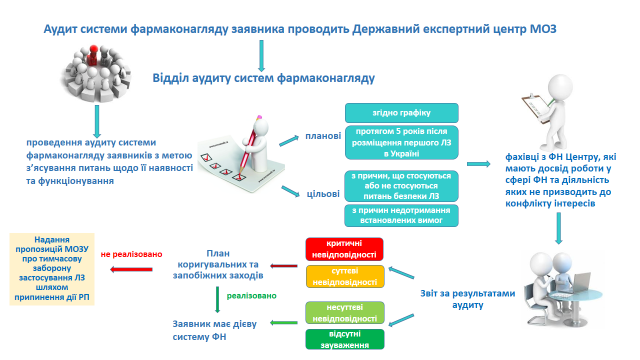
Метою проведення аудиту системи фармаконагляду заявників є з’ясування питань щодо її наявності та функціонування, та її відповідності вимогам чинного законодавства України щодо здійснення фармаконагляду.
Заявник має створити, забезпечити та гарантувати функціонування у себе системи фармаконагляду в Україні, що є обов’язковою умовою обігу лікарських засобів, вакцин, туберкуліну на території України, відповідно до вимог Порядку здійснення фармаконагляду.
Опис системи фармаконагляду заявника повинен міститись у документі майстер-файл системи фармаконагляду (далі – МФСФ), який використовується заявником стосовно одного або декількох лікарських засобів. МФСФ складається відповідно до структури, наведеної у додатку 11 до Порядку здійснення фармаконагляду
Відповідно до вимог Порядку здійснення фармаконагляду, система фармаконагляду заявника складається з елементів, що дають змогу здійснювати моніторинг безпеки лікарських засобів та визначати будь-які зміни співвідношення користь/ризик.
Також при здійсненні фармаконагляду заявник/його представник може користуватися рекомендаціями стандарту «Настанова. Лікарські засоби. Належна практика з фармаконагляду. СТ-Н МОЗУ 42-8.7:2015», затвердженого наказом Міністерства охорони здоров’я України від 21 травня 2015 року № 299 (у редакції наказу Міністерства охорони здоров’я України від 05 квітня 2018 року № 620). Вимоги до МФСФ викладені у частині II Настанови
Аудит системи фармаконагляду – це важлива подія для заявника та його договірних партнерів, що вимагає уважної підготовки і вирішення виявлених проблем.
Відповідно до Порядку здійснення фармаконагляду аудит системи фармаконагляду може бути плановий та цільовий.
При формуванні графіку проведення планових аудитів систем фармаконагляду заявників враховуються фактори, що базуються на системному та ризик-орієнтованому підході.
Інформацію щодо запланованих аудитів систем фармаконагляду заявників буде оприлюднено на сайті Державного експертного центру МОЗ Центру за посиланням:
«Інформація щодо запланованих аудитів систем фармаконагляду заявників »
Цільовий аудит може бути проведений:
– з причин, що не стосуються питань, пов’язаних з безпекою лікарських засобів, вакцин, туберкуліну, або з причин недотримання встановлених вимог (зміни в організаційно-правовій формі підприємств, значна зміна власної системи фармаконагляду тощо);
– з причин, що стосуються питань, пов’язаних з безпекою лікарського засобу, вакцини, туберкуліну, або з причин недотримання встановлених вимог (несвоєчасне подання повідомлень про випадки побічних реакцій лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу, подання повідомлень не в повному обсязі, подання доповнень до огляду клінічних даних невідповідної якості, подання регулярних звітів з безпеки невідповідної якості, подання планів управління ризиками невідповідної якості, невідповідність даних, зазначених у повідомленнях, даним з інших джерел інформації; зміни у співвідношенні користь/ризик, результати попередніх аудитів, оприлюднення інформації з фармаконагляду, яка є необ’єктивною чи вводить в оману громадськість, тощо).
За результатами проведення аудиту системи фармаконагляду заявника буде складено звіт, що підтверджуватиме факт проведення аудиту, та у якому будуть зазначені зауваження щодо системи фармаконагляду заявника, виявлені порушення/недоліки, невідповідності (критичні, суттєві, несуттєві), у разі їх наявності.
Кінцева мета полягає в тому, щоб привести систему фармаконагляду заявника у відповідність до нормативно-правових вимог, використовуючи найбільш відповідний метод (або комбінацію методів), доступний у наборі аудиторів.
У разі виявлення критичних та/або суттєвих невідповідностей та порушень (недоліків) заявник має надіслати до Відділу аудиту систем фармаконагляду заявника Державного експертного центру МОЗ для погодження інформацію щодо строків коригувальних та запобіжних заходів для їх усунення. Ця інформація має надаватися у формі плану коригувальних та запобіжних заходів з метою усунення виявлених невідповідностей.
Керівництво для заявника з надання відповіді на результати аудиту систем фармаконагляду та приклад коректного та некоректного заповнення заявником таблиці за результатами аудиту систем фармаконагляду.
Аудит є нагодою для:
- порушення питання про важливість діяльності з фармаконагляду у бізнес-процесі та отримання більшої підтримки від керівництва;
- удосконалення процесів у фармаконагляді;
- навчання та підвищення кваліфікації співробітників.
У разі якщо заявником не усунено протягом визначеного строку критичні невідповідності, виявлені під час проведення аудиту системи фармаконагляду заявника Державним експертним центром МОЗ будуть надані до Міністерства охорони здоров’я України пропозиції про тимчасову заборону застосування лікарського(их) засобу(ів), шляхом припинення дії реєстраційного посвідчення такого заявника у зв’язку з відсутністю у заявника системи фармаконагляду або її складових відповідно до підпункту 9 пункту 1 розділу II Порядку припинення дії реєстраційного посвідчення на лікарський засіб, затвердженого наказом Міністерства охорони здоров’я України від 05 серпня 2020 року N 1801
Відділ аудиту системи фармаконагляду заявників проводить інформаційні сесії/навчальні семінари щодо організації системи фармаконагляду заявників та проведення аудитів фармаконагляду заявників.
Найчастіші запитання щодо аудиту системи фармаконагляду заявника
У разі наявності питань щодо аудиту системи фармаконагляду Ви маєте змогу звернутись до Відділ аудиту системи фармаконагляду заявників, надіславши запитання на електронну пошту: gpvp-audit@dec.gov.ua або скористатись можливістю Online консультації Відповідь на поставлене запитання, надана в межах повноважень Центру, буде надіслана на Вашу адресу.